AREQUIPE CACERO
Albert Calderon - Gustavo Ramirez - Sebastian Lozada.
viernes, 8 de agosto de 2014
lunes, 28 de julio de 2014
SALSA DE TOMATE
ELABORACIÓN DE LA SALSA DE TOMATE
COMPOSICIÓN DEL PRODUCTO
La salsa de tomate es el producto elaborado a partir de
tomates sanos y maduros,enteros, troceados, o pulpa o concentrado de tomate,
sal, vinagre, condimentos,especies y aditivos permitidos.
CARACTERÍSTICAS DEL PRODUCTO
No debe contener dentro de la formulación: Almidones
naturales o modificados, frutas uhortalizas, se acepta la adición de espesantes
y estabilizantes hasta un 6 % máximo en masa solo en mezcla en el producto
terminado.
DESCRIPCIÓN DEL PRODUCTO Y DEL PROCESO
Es un producto que se obtiene por evaporación parcial del
agua contenida en la pulpa de tomate y adición de sal, especias, vinagre. La
salsa guarda las propiedades organolépticas del tomate, y en el proceso se puede
agregar azúcar para dar un sabor dulce y espesantes para lograr mayor consistencia.
Existen en el mercado variedad de salsas y pastas de tomate que se presentan en
frascos o latas, diferenciándose por su condimentación y espesor (grado de
concentración). A nivel industrial la salsa se elabora a partir de una pasta de
tomate concentrada, la cual se diluye con agua y se mezcla con sal, azúcar,
especias y vinagre. No obstante, una salsa de óptima calidad solamente se puede
elaborar a partir de tomates frescos.
MATERIA PRIMA E INGREDIENTES
•Tomates maduros
•Vinagre
•Sal
•Especias
INSTALACIONES Y EQUIPOS
El local debe ser lo suficientemente grande para albergar
las siguientes áreas: recepción de la fruta, proceso, empaque, bodega,
laboratorio, oficina, servicios sanitarios y vestidor.La construcción debe ser
en bloc repellado con acabado sanitario en las uniones del piso y pared para
facilitar la limpieza.Los pisos deben ser de concreto recubiertos de losetas o
resina plástica, con desnivel para el desagüe. Los techos de estructura
metálica, con zinc y cielorraso. Las puertas de metal o vidrio y ventanales de vidrio.
Se recomienda el uso de cedazo en puertas y ventanas.
•Estufa
•Despulpador (licuadora)
•Reloj
•Balanza
•Baño maría, campana o túnel con vapor
DESCRIPCIÓN DEL PROCESO
•Recepción y pesado:
Consiste en cuantificar el tomate que entrará al proceso para
determinar rendimientos. La recepción debe hacerse en recipientes adecuados y
limpios, y con ayuda de una balanza de piso.
•Selección:Se seleccionan los tomates maduros, completamente rojos, con
la pulpa firme y sin signos de
podredumbre. Para la
elaboración de salsa no interesa el tamaño ni la forma, pero si el color.
•Lavado:Los tomates se lavan con agua clorada. Un buen lavado
asegura la eliminación de la suciedad, restos de pesticidas y microorganismos superficiales.
•Trozado:Con ayuda de cuchillos
limpios, se cortan los tomates en cuartos.No es necesario pelarlos.
•Escurrido:Sirve para eliminar parte
del agua de los tomates, con el fin de ahorrar tiempo en las etapas posteriores.
Para ello, se envuelven los tomates en una bolsa de manta o malla plástica, la
que se cuelga y se deja escurrir durante 30 minutos.
•Escaldado: Los tomates se sumergen
en agua limpia y se calientan a 90-95 °C durante 5 minutos. Esta operación tiene
como propósitos: destruir las enzimas responsables de las pérdidas de color,
reducir la carga de microorganismos presente y ablandar los tomates para
facilitar la extracción de la pulpa.
•Extracción de la pulpa:Se hace con
un despulpador o una licuadora. En el segundo caso, la pulpa se debe colar para
separar las cáscaras y semillas.
•Concentración:La pulpa se cocina
por un tiempo de 30 a 45 minutos, a una temperatura de 90-95 °C, agitando suave
y constantemente. El tiempo decocción estará determinado por la concentración final
que se desee, por lo general entre 25 y 30 °Brix. En esta parte se agrega sal en
una proporción del 2%, con relación al peso de la pulpa, es decir, a 100 Kg. de
pasta elaborada, se deben de agregar 2 Kg. de sal. También pueden agregarse
condimentos tales como, ajo, orégano y albahaca.
•Envasado:El envasado se hace en
frascos o botellas de vidrio que han sido previamente esterilizados. La salsa se
chorrea a una temperatura mínima de 85 C, y para evitar que queden burbujas de
aire los envases se golpean suavemente en el fondo a medida que se van llenando.
Se debe dejar un espacio sin llenar equivalente al 10% del volumen del envase.
Por último se ponen las tapas, sin cerrar completamente pero que tampoco queden
sueltas.
•Pasteurizado:Se hace para eliminar
los microorganismos que pudieran haber sobrevivido a las temperaturas del
proceso y así garantizar la vida útil del producto. El pasteurizado se hace
calentando los envases a 95 °C por 10 minutos, contados a partir de que el agua
comienza a hervir. Al finalizar el tratamiento se termina de cerrar las tapas.
•Enfriado:Los envases se enfrían hasta la temperatura ambiente. Para
ello se colocan en otro recipiente con agua tibia (para evitar que el choque
térmico los quiebre) y luego se va agregando agua más fría hasta que los envases
alcancen la temperatura ambiental.
•Etiquetado y almacenado:Consiste en el pegado de etiquetas
(con los requerimientos de la ley), luego el producto se coloca en cajas de
cartón, y estas cajas se almacenan en un lugar fresco, seco y oscuro, hasta su
distribución.
TIPOS DE ANÁLISIS
Para la caracterización del producto se hacen análisis como:
•Determinación de Ph.
•Determinación de grados Brix.
•Determinación de acidez.
•Determinación de humedad.
•Análisis sensorial.Además los
anteriores análisis se realizan control de calidad en la materia prima, enel
proceso y en el producto final.
•En la materia prima
Los tomates deben ser frescos, completamente rojos y sanos.
•En el proceso
Los tratamientos de cocción y de pasteurizado se deben
efectuar con el tiempo ytemperaturas necesarias, para lograr el espesor
deseado.
•En el producto final
Debe chequearse, la textura, el color, el sabor, el olor, el
grado de concentración(grados brix). Además debe chequearse el sello y
contenido de la botella.
PROCESO DE INVESTIGACION
A demás del proceso de creación, debemos tener por lo menos 3 envases con el producto pasteurizado:
1. Queda como muestra patrón, no se abrirá si no hasta que el proceso de valoración de durar unas semanas termine.
2.Este se abrirá 2 días después de haber hecho en producto, se dejara abierto de 3 a 4 horas una vez cumplido el tiempo se sella de nuevo y se almacena.
3.Esta es la muestra a dar a conocer.
PROCESO DE INVESTIGACION
A demás del proceso de creación, debemos tener por lo menos 3 envases con el producto pasteurizado:
1. Queda como muestra patrón, no se abrirá si no hasta que el proceso de valoración de durar unas semanas termine.
2.Este se abrirá 2 días después de haber hecho en producto, se dejara abierto de 3 a 4 horas una vez cumplido el tiempo se sella de nuevo y se almacena.
3.Esta es la muestra a dar a conocer.
domingo, 2 de febrero de 2014
QUIMICA ORGANICA
HECHO POR:
NESTOR JAVIER GIL ROJAS
SEBASTIAN LOZADA FLOREZ
ALBERT ALFONSO CALDERON
GRADO: 11-1M
La química orgánica es una rama de la química en la que se estudian los compuestos del carbono y sus reacciones.
Existe una amplia gama de sustancias (medicamentos, vitaminas, plásticos, fibras sintéticas y naturales, hidratos de carbono, proteínas y grasas) formadas por moléculas orgánicas.
Los químicos orgánicos determinan la estructura de las moléculas orgánicas, estudian sus reacciones y desarrollan procedimientos para sintetizar compuestos orgánicos.
Esta rama de la química ha afectado profundamente la vida desde el siglo XX: ha perfeccionado los materiales naturales y ha sintetizado sustancias naturales y artificiales que, a su vez, han mejorado la salud, han aumentado el bienestar y han favorecido la utilidad de casi todos los productos actuales.
Materiales orgánicos son todos aquellos que poseen en su estructura química el elemento carbono, por lo tanto entran en su categoría todos los seres vivos, los hidrocarburos, y en especial el petróleo y sus derivados, etc.
La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas era necesaria la intervención de lo que llamaban 'la fuerza vital' es decir, los organismos vivos.
Algunos de estos ejemplos son considerados a continuación.
La materia viviente es, en parte, materia constituida por derivados del carbono. Las transformaciones que sufren los seres vivos, y que observamos a simple vista, se corresponden, desde un punto de vista submicroscópico o molecular, con cambios o reacciones químicas de las sustancias biológicas. Azúcares, grasas, proteínas, hormonas, ácidos nucleicos, son algunos ejemplos de sustancias, todas ellas compuestos del carbono, de cuya síntesis y degradación en el interior de los organismos vivos se ocupa la bioquímica.
► La Química Orgánica es importante porque gracias a la química orgánica existe todo lo que hoy podemos percibir y sentir, ya que todo los productos orgánicos están presentes en todos los aspectos de nuestra vida, como por ejemplo:
- La ropa que vestimos.
- Los jabones, shampoos, desodorantes.
- Medicinas, perfumes, utensilios de cocina.
- La comida, etc.
► Es importante porque nos permite conocimiento de todo lo que funciona en nuestro organismo y el conocimiento de hasta todo nuestro propio cuerpo como por ejemplo:
- La progesterona.
- El colesterol, etc.
► Es importante porque sino hubiese existido la química orgánica no hubiéramos obtendrído medicamentos ni medicinas artificiales, es que gracias a la química orgánica es que va avanzando con el tiempo la tecnología, tanto en la medicina para crear y descubrir nuevos medicamentos que puedan combatir las enfermedades mortales de hoy en día.
► Importante porque todos los compuestos responsables de la vida, son sustancias orgánicas.
► Importante porque el progreso de la Química Orgánica permite profundizar en el esclarecimiento de los procesos vitales.
► La industria química (fármacos, polímeros, pesticidas, herbicidas) juega un papel muy importante en la economía mundial e incide en muchos aspectos de nuestra vida diaria con sus productos.
http://www.profesorenlinea.cl/Quimica/Quimica_organica.html
http://quimica04salinas.blogspot.com/2010/04/la-importancia-de-la-quimica-organica.html
NESTOR JAVIER GIL ROJAS
SEBASTIAN LOZADA FLOREZ
ALBERT ALFONSO CALDERON
GRADO: 11-1M
La química orgánica es una rama de la química en la que se estudian los compuestos del carbono y sus reacciones.
Existe una amplia gama de sustancias (medicamentos, vitaminas, plásticos, fibras sintéticas y naturales, hidratos de carbono, proteínas y grasas) formadas por moléculas orgánicas.
Los químicos orgánicos determinan la estructura de las moléculas orgánicas, estudian sus reacciones y desarrollan procedimientos para sintetizar compuestos orgánicos.
Esta rama de la química ha afectado profundamente la vida desde el siglo XX: ha perfeccionado los materiales naturales y ha sintetizado sustancias naturales y artificiales que, a su vez, han mejorado la salud, han aumentado el bienestar y han favorecido la utilidad de casi todos los productos actuales.
Materiales orgánicos son todos aquellos que poseen en su estructura química el elemento carbono, por lo tanto entran en su categoría todos los seres vivos, los hidrocarburos, y en especial el petróleo y sus derivados, etc.
La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas era necesaria la intervención de lo que llamaban 'la fuerza vital' es decir, los organismos vivos.
Importancia de la química orgánica
A pesar de su aparición tardía en la historia de la química, la química de los compuestos del carbono es en la actualidad la rama de las ciencias químicas que crece con mayor rapidez. La variedad de productos derivados del carbono puede resultar prácticamente ilimitada debido a las propiedades singulares de dicho átomo y, por tanto, constituye una fuente potencial de nuevos materiales con propiedades especiales, de medicamentos y productos sanitarios, de colorantes, de combustibles, etc.Algunos de estos ejemplos son considerados a continuación.
La materia viviente es, en parte, materia constituida por derivados del carbono. Las transformaciones que sufren los seres vivos, y que observamos a simple vista, se corresponden, desde un punto de vista submicroscópico o molecular, con cambios o reacciones químicas de las sustancias biológicas. Azúcares, grasas, proteínas, hormonas, ácidos nucleicos, son algunos ejemplos de sustancias, todas ellas compuestos del carbono, de cuya síntesis y degradación en el interior de los organismos vivos se ocupa la bioquímica.
► La Química Orgánica es importante porque gracias a la química orgánica existe todo lo que hoy podemos percibir y sentir, ya que todo los productos orgánicos están presentes en todos los aspectos de nuestra vida, como por ejemplo:
- La ropa que vestimos.
- Los jabones, shampoos, desodorantes.
- Medicinas, perfumes, utensilios de cocina.
- La comida, etc.
► Es importante porque nos permite conocimiento de todo lo que funciona en nuestro organismo y el conocimiento de hasta todo nuestro propio cuerpo como por ejemplo:
- La progesterona.
- El colesterol, etc.
► Es importante porque sino hubiese existido la química orgánica no hubiéramos obtendrído medicamentos ni medicinas artificiales, es que gracias a la química orgánica es que va avanzando con el tiempo la tecnología, tanto en la medicina para crear y descubrir nuevos medicamentos que puedan combatir las enfermedades mortales de hoy en día.
► Importante porque todos los compuestos responsables de la vida, son sustancias orgánicas.
► Importante porque el progreso de la Química Orgánica permite profundizar en el esclarecimiento de los procesos vitales.
► La industria química (fármacos, polímeros, pesticidas, herbicidas) juega un papel muy importante en la economía mundial e incide en muchos aspectos de nuestra vida diaria con sus productos.
http://www.profesorenlinea.cl/Quimica/Quimica_organica.html
http://quimica04salinas.blogspot.com/2010/04/la-importancia-de-la-quimica-organica.html
sábado, 8 de junio de 2013
LABORATORIO DEL PH
El pH es una medida de
acidez o alcalinidad de una disolución. El pH indica la concentración de iones
hidronio [H3O+] presentes en determinadas sustancias.
La sigla significa ‘potencial hidrógeno’, ‘potencial de hidrógeno’ o
‘potencial de hidrogeniones’ (pondus Hydrogenii o potentia Hydrogenii; del
latín pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrógeno).
Este término fue acuñado por el químico danés S. P. L. Sørensen (1868-1939),
quien lo definió como el logaritmo negativo en base 10 de la actividad de los
iones hidrógeno. LA ESCALA DE PH
La escala de pH mide el
grado de acidez de un objeto. Los objetos que no son muy ácidos se llaman
básicos. La escala tiene valores que van del cero (el valor más ácido) al 14
(el más básico). Tal como puedes observar en la escala de pH que aparece arriba,
el agua pura tiene un valor de pH de 7. Ese valor se considera neutro – ni
ácido ni básico. La lluvia limpia normal tiene un valor de pH de entre 5.0 y
5.5, nivel levemente ácido. Sin embargo, cuando la lluvia se combina con
dióxido de azufre y óxidos de nitrógeno—producidos por las centrales eléctricas
y los automóviles—la lluvia se vuelve mucho más ácida. La lluvia ácida típica
tiene un valor de pH de 4.0. Una disminución en los valores de pH de 5.0 a 4.0
significa que la acidez es diez veces mayor.
COMO SE MIDE EL PH
En los laboratorios se
emplean numerosos dispositivos de alta tecnología para medir el pH. Una manera
muy fácil en la que puedes medir el pH es usando una tira de papel tornasol.
Cuando tocas algo con una tira de papel tornasol, el papel cambia de color
dependiendo de si la substancia es ácida o básica. Si el papel se vuelve rojo
es porque la substancia es ácida, y si se vuelve azul quiere decir que la
substancia es básica.
LABORATORIO
MATERIALES:
- Bata Blanca De Laboratorio
- Guantes De Latex
- Cinta De Enmascarar
- 1 Limon
- 1 Naranja
- Soda Caustica
- Antiacido (Milanta)
- Agua De Repollo (Morada)
- Acido Sulfurico
- Sal De Frutas
- Alka.Seltzer
- Tubos De Ensallo
- Gradilla
DESARROLLO DEL LABORATORIO
- Cada Uno Se Pone Su Bata De Laboratorio Y Sus Guantes De Látex Para Prevenir Un Accidente
- Lavamos Los Materiales (Tubos De Ensayo) Para Prevenir Alguna Otra Partícula Que Dañe El Laboratorio
- Marcamos Los Tubos De Ensayo Con La Cinta De Enmascarar Del 1 - 6
- Repartimos En Cada Tubo El Agua De Repollo Recuerda Que Todos Por Igual
5. Cogemos El Tubo #1 Y Le Agregamos Soda Caustica:
Como Pudimos Observar En El Vídeo Al Comienzo Se Pone De Color Verde Pero El Verdadero Resultado Que Se Obtiene Al Agregar La Soda Caustica Es Un Color Amarillo.
6. Cogemos El Tubo #2 Y Le Agregamos Naranja:
Como Podemos Observar En El Vídeo El Resultado Que Se Obtiene Al Agregar La Naranja Es Un Color Violeta.
7. Cogemos El Tubo #3 Y Le Agregamos El Limón:
Como Podemos Observar En El Vídeo El Resultado Que Se Obtiene Al Agregar El Limon Es Un Color Rojo Violeta.
8. Cogemos El Tubo #4 Y Le Agregamos Sal De Frutas:
Como Podemos Observar En El Vídeo El Resultado Que Se Obtiene Al Agregar El Sal De Frutas Es Un Color Azul Violeta.
9. Cogemos El Tubo #5 Y Le Agregamos El Antiacido (Milanta)
Como Podemos Observar En El Vídeo El Resultado Que Se Obtiene Al Agregar El Antiacido Es Un Color Verde Azulado.
10. Cogemos El Tubo #6 Y Le Agregamos El Ácido Sulfúrico:
Como Podemos Observar En El Vídeo El Resultado Que Se Obtiene Al Agregar El Ácido Sulfúrico Es Un Color Un Rojo Intenso.
11. Luego De Tenerlos Todos Se Organizan Según Su PH:
12. Luego De Dar Por Terminado El Laboratorio Se Debe Dejar El Puesto De Trabajo Completamente Limpio Con Todos Los Útiles:
BIBLIOGRAFIA
http://es.wikipedia.org/wiki/PH
http://www.google.com.co/search?sugexp=cqrwrth&gs_rn=16&gs_ri=psy-ab&suggest=p&cp=11&gs_id=1u&xhr=t&q=tabla+de+ph&bav=on.2,or.r_qf.&bvm=bv.47534661,d.dmg&biw=1088&bih=533&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=tEOzUfKYE9Lh4APklIDoDQ#imgrc=_
sábado, 1 de junio de 2013
MATERIALES DE LABORATORIO
Vasos de precipitado: Pueden ser de dos formas: altos o
bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al
tener mucha anchura nunca dan volúmenes precisos). Se pueden calentar (pero no
directamente a la llama) con ayuda de una rejilla.
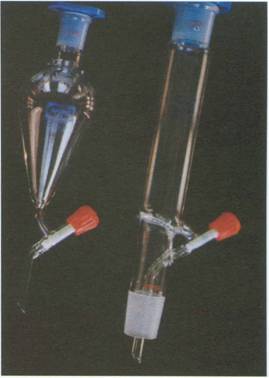
Desecador: Recipiente de vidrio que se utiliza para evitar
que los solutos tomen humedad ambiental. En (2), donde hay una placa, se coloca
el soluto y en (1) un deshidratante.

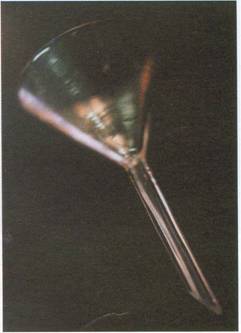
Embudo de vidrio: Se emplea para trasvasar líquidos o
disoluciones de un recipiente a otro y también para filtrar, en este caso se
coloca un filtro de papel cónico o plegado.
Buchner y Kitasato: El Buchner es un embudo de porcelana,
tiene una placa filtrante de agujeros grandes por lo que se necesita colocar un
papel de filtro circular, que acople perfectamente, para su uso. Se emplea
para filtrar a presión reducida. Su uso va unido al Kitasato, recipiente de
vidrio con rama lateral para conectar con la bomba de vacío (normalmente, una
trompa de agua).

Cristalizador: Puede ser de forma baja o alta. Es un
recipiente de vidrio donde al añadir una disolución se intenta que, en la
mejores condiciones, el soluto cristalice.

Vidrio de reloj: Lámina de vidrio cóncavo-convexa que se
emplea para pesar los sólidos y como recipiente para recoger un precipitado
sólido de cualquier experiencia que se introducirá en un desecador o bien en
una estufa.
Filtro plegado: Se elabora con papel de filtro, sirve para
filtrar, se coloca sobre el embudo de vidrio y el líquido atraviesa el papel
por acción de la gravedad; el de pliegues presenta mayor superficie de contacto
con la suspensión.

Embudos de
decantación: Son de vidrio. Pueden ser cónicos o cilíndricos. Con llave de
vidrio o de teflón. Se utilizan para separar líquidos, inmiscibles, de
diferente densidad.
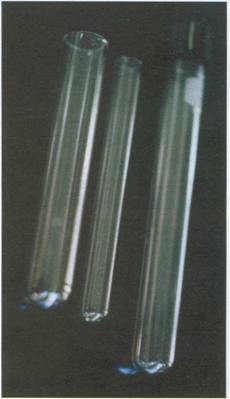
Tubos de ensayo: Recipiente de vidrio, de volumen variable,
normalmente pequeño. Sirven para hacer pequeños ensayos en el laboratorio. Se
pueden calentar, con cuidado, directamente a la llama. Se deben colocar en la
gradilla y limpiarlos una vez usados, se colocan invertidos para que escurran.
Si por algún experimento se quiere mantener el líquido, se utilizan con tapón
de rosca.
Probeta: Recipiente de vidrio para medir volúmenes, su
precisión es bastante aceptable, aunque por debajo de la pipeta. Las hay de
capacidades muy diferentes: 10, 25, 50 y 100 ml.

Pipetas: Recipientes de vidrio para medir volúmenes, son de
gran precisión. Las hay de capacidades muy diferentes: 0'1, 1'0, 2'0, 5'0,
10'0.............. ml (las más precisas miden μI). En cuanto a la forma de
medir el volumen, podemos distinguir entre: graduadas: sirven para poder medir
cualquier volumen inferior al de su máxima capacidad; de enrase (sólo sirven
para medir el volumen que se indica en la pipeta): a su vez pueden ser simples
o dobles. La capacidad que se indica en una pipeta de enrase simple comprende
desde el enrase marcado en el estrechamiento superior hasta el extremo
inferior. En una pipeta de enrase doble, la capacidad queda enmarcada entre las
dos señales.
Si el líquido no ofrece peligrosidad, colocando la boca en
la parte superior de la pipeta, se succiona y se hace subir el líquido un poco
por encima del enrase. La pipeta se cierra con el dedo índice.
Al vaciar la pipeta se debe hacer lentamente para evitar que
quede líquido pegado a las paredes. La última gota no es necesario recogerla
porque ya viene aforada para que quede sin caer (salvo que se indique lo
contrario en la propia pipeta).
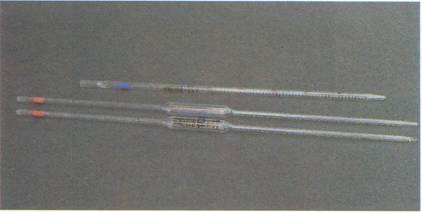
Buretas: Material de vidrio para medir volúmenes con toda
precisión. Se emplea, especialmente, para valoraciones. La llave sirve para
regular el líquido de salida. Manejo: 1) se llena con la ayuda de un embudo. 2)
los líquidos han de estar a la temperatura ambiente. 3) el enrase debe hacerse
con la bureta llena (aunque también se puede enrasar a cualquier división),
tomando como indicador la parte baja del menisco. 4) la zona que hay entre la
llave y la boca de salida debe quedar completamente llena de líquido.
Pueden ser: a) rectas. b) con depósito. c) de sobremesa con
enrase automático.
Matraz Aforado:
Material de vidrio para medir volúmenes con gran precisión. Existen de capacidades
muy variadas: 5, 10, 25, 50, 100, 250, 500, 1.000 mI. Sólo mide el volumen que
se indica en el matraz. No se puede calentar ni echar líquidos calientes. El
enrase debe hacerse con exactitud, procurando que sea la parte baja del menisco
del líquido la que quede a ras de la señal de aforo. Se emplea en la
preparación de disoluciones.
Frasco cuentagotas
con tetina: Normalmente se utilizan para contener disoluciones recién
preparadas, se acompañan de cuentagotas para poder facilitar las reacciones de
tipo cualitativo.


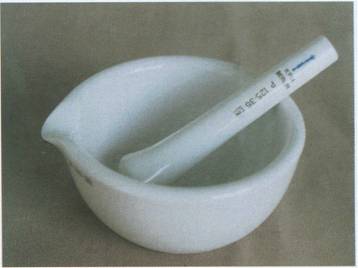
Mortero con mano o mazo: Pueden ser de vidrio, ágata o
porcelana. Se utilizan para triturar sólidos hasta volverlos polvo, también
para triturar vegetales, añadir un disolvente adecuado y posteriormente extraer
los pigmentos, etc.
Escobilla y escobillón: Material fabricado con mechón de
pelo natural, según el diámetro se utilizan para lavar: tubos de ensayo,
buretas, vasos de precipitado, erlenmeyer, etc.

Erlenmeyer: Matraz
de vidrio donde se pueden agitar disoluciones, calentarlas (usando rejillas),
etc. Las graduaciones sirven para tener un volumen aproximado. En una
valoración es el recipiente sobre el cual se vacía la bureta.

Matraz: Instrumento de laboratorio que se utiliza, sobre
todo, para contener y medir líquidos. Es un recipiente de vidrio de forma
esférica o troncocónica con un cuello cilíndrico.

sábado, 18 de mayo de 2013
Utilidades De Los Hidróxidos En La Industria
Ejemplos significativos de este uso son la producción de
amoniaco para fertilizantes o la desulfuración de los productos derivados del
petróleo.
De igual modo la industria del gas ha hecho uso del hidrógeno en forma líquida y en forma gaseosa para múltiples aplicaciones con un envidiable historial de seguridad. También la industria eléctrica ha empleado el gas de hidrógeno con objeto de enfriar el rotor y el estator de grandes turbinas.
El hidrógeno líquido es el combustible empleado para la propulsión de los cohetes espaciales. Su uso en las lanzaderas espaciales es doble ya que no sólo alimenta (junto con el oxígeno) los reactores principales de las lanzaderas espaciales sino que también es el encargado de generar, mediante pilas de combustible, la electricidad y el agua necesarios para los sistemas y ocupantes del vehículo espacial.
El hidrógeno se utiliza también en el sector de la alimentación para la hidrogenación de los aceites y grasas vegetales y animales. Además tiene aplicación en el campo metalúrgico por su habilidad para reducir los óxidos metálicos y prevenir la oxidación en tratamientos térmicos de ciertos materiales y aleaciones. Además tiene uso en el corte y la soldadura de metales. Por otro lado, y como ya se ha comentado anteriormente, el hidrógeno es extensamente empleado en la síntesis del amoniaco y en las operaciones de refino del petróleo. A su vez el hidrógeno líquido se emplea como combustible primario de los cohetes espaciales junto con oxígeno o fluoruros y como combustible en los cohetes de propulsión nuclear y los vehículos espaciales.
De igual modo la industria del gas ha hecho uso del hidrógeno en forma líquida y en forma gaseosa para múltiples aplicaciones con un envidiable historial de seguridad. También la industria eléctrica ha empleado el gas de hidrógeno con objeto de enfriar el rotor y el estator de grandes turbinas.
El hidrógeno líquido es el combustible empleado para la propulsión de los cohetes espaciales. Su uso en las lanzaderas espaciales es doble ya que no sólo alimenta (junto con el oxígeno) los reactores principales de las lanzaderas espaciales sino que también es el encargado de generar, mediante pilas de combustible, la electricidad y el agua necesarios para los sistemas y ocupantes del vehículo espacial.
El hidrógeno se utiliza también en el sector de la alimentación para la hidrogenación de los aceites y grasas vegetales y animales. Además tiene aplicación en el campo metalúrgico por su habilidad para reducir los óxidos metálicos y prevenir la oxidación en tratamientos térmicos de ciertos materiales y aleaciones. Además tiene uso en el corte y la soldadura de metales. Por otro lado, y como ya se ha comentado anteriormente, el hidrógeno es extensamente empleado en la síntesis del amoniaco y en las operaciones de refino del petróleo. A su vez el hidrógeno líquido se emplea como combustible primario de los cohetes espaciales junto con oxígeno o fluoruros y como combustible en los cohetes de propulsión nuclear y los vehículos espaciales.
En las industrias y en la vida diaria, se utilizan una
gran variedad de hidróxidos, tales como el Na (OH) fabricación del papel,
jabones, fibras textiles, etc. "Debe manejarse con mucha precaución por
que causa lesiones muy dolorosas en la piel por su contacto directo con el
hidróxido de sodio". Otro hidróxido conocido es el Hidróxido de calcio,
llamado también cal apagada. Se emplea en la construcción para obtener la pasta
que une los ladrillos, además se utiliza
en la odontología para reparar las dentaduras dañadas. Para formar los
hidróxidos a partir del óxido básico y el agua, primero tenemos que saber como
se ioniza la molécula del agua. El agua es un electrolito débil, poco
disociado. Cuando ocurre esta disociación, existirán tanto iones hidrógenos
(tienen carga positiva) como iones
oxhidrilos o hidroxilos (tienen carga negativa).
La generación de hidrógeno a través de plantas nucleares
constituye una de las mejores alternativas para obtener una fuente de energía
limpia, barata y segura.
El término economía del hidrógeno engloba
las posibilidades que este gas ofrece, como es el hecho de poder generarlo de
forma limpia (además, presenta una nula emisión de gases invernadero durante su
combustión) y económica, pues tiene un alto contenido energético (un kilogramo
de hidrógeno puede producir energía equivalente a 2.8 kg de gasolina o 2.4 kg
de gas metano); un ejemplo: se estima que un automóvil prototipo con celdas
combustibles de hidrógeno necesitaría aproximadamente 4 kg de hidrógeno para
recorrer 500 kilómetros .
Estas son características que hacen del hidrógeno una
fuente de energía muy atractiva, con grandes beneficios en comparación con las
empleadas hasta el momento, y útil para atender la mayor parte de las
necesidades energéticas de la sociedad; no obstante, su implantación no es
inmediata, pues existen aún algunos problemas que serán comentados brevemente
en este texto.
http://www.emagister.com/curso-formacion-compuestos-inorganicos/hidroxidos
http://espanol.answers.yahoo.com/question/index?qid=20120201081939AARxYOz
jueves, 25 de abril de 2013
Funciones Químicas Y Grupos Funcionales
Funciones Químicas
El
carbono (C) está ubicado en la segunda hilera de la tabla
periódica y tiene cuatro electrones de enlace en su envoltura
de valencia. Al igual que otros no metales, el carbono necesita ocho
electrones para completar su envoltura de valencia.
Por consiguiente, el
carbono puede formar hasta cuatro enlaces con otros átomos (cada enlace
representa uno de los electrones del carbono y uno de los electrones del átomo
que se enlazan).
Cada valencia
de electrón participa en el enlace, por consiguiente el enlace del
átomo de carbono se distribuirá de modo uniforme sobre la superficie del átomo.
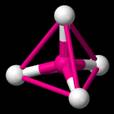
Estos enlaces forman
un tetradrón (una pirámide con una punta en la parte superior), como
se ilustra en la figura a la derecha.
La diversidad de los
productos químicos orgánicos se debe a la infinidad de opciones que brinda el
carbono para enlazarse con otros átomos. Los químicos orgánicos más simples,
llamadoshidrocarburos, contienen sólo carbono y átomos de hidrógeno; el
hidrocarburo más simple (llamado metano) contiene un solo átomo de carbono
enlazado a cuatro átomos de hidrógeno.
Pero el carbono también puede enlazarse con otros átomos de carbono adicionalmente al hidrógeno tal como se ilustra en el siguiente dibujo de la molécula etano (CH3—CH3)
Pero el carbono también puede enlazarse con otros átomos de carbono adicionalmente al hidrógeno tal como se ilustra en el siguiente dibujo de la molécula etano (CH3—CH3)
Recordemos:
Cada grupo funcional determina las propiedades químicas de las
sustancias que los poseen; es decir, determina su función química.
Entonces, se llama función química a las propiedades comunes que
caracterizan a un grupo de sustancias que tienen estructura semejante; es
decir, que poseen un determinado grupo funcional.
Existen funciones en la química inorgánica y en la química orgánica y
para comprender el término función podemos hacer una analogía con el concepto
de familia.
En una familia hay rasgos característicos que identifican a sus
miembros, de la misma manera se podría afirmar que en las sustancias, tanto
orgánicas como inorgánicas, existen agrupaciones de átomos, o grupo
funcional, que debido a sus características comunes poseen un comportamiento
típico.
Si nos referimos a las funciones en química inorgánica, se pueden
distinguir cinco grandes familias, las cuales poseen ramificaciones filiales y
que se organizan de la siguiente manera:
1.- Óxidos: (Ácidos, Básicos, Neutros, Peróxidos y Superóxidos).
2.- Hidróxidos.
3.- Ácidos: (Hidrácidos y Oxácidos).
4.- Sales: (Haloideas y Oxisales (Neutras, Ácidas, Básicas y Dobles)).
5.- Hidruros: Metálicos y no Metálicos.
En tanto las funciones de la química orgánica son muchas más, destacándose
entre todas la función hidrocarburo, porque de ella se desprenden todas las
demás.
En química orgánica, dependiendo de si el grupo funcional característico
posee átomos de oxígeno, de nitrógeno o es algún halógeno, la función química
será oxigenada, nitrogenada o halogenada.
Los Grupos Funcionales Son
- Óxidos:
Oxido
de Zinc: Se usa como pigmento e inhibidor del crecimiento de hongos en
pinturas, como rellenador en llantas de goma y como pomada antiséptica en
medicina.
Oxido
de Magnesio: como antiácido para aliviar los malestares estomacales causados
por el calor o la acidez estomacal.
Oxido
cúprico: es usado como pigmento en cerámicas para producir azul, rojo, y verde
(y, a veces, gris, rosa o negro). También es usado produce para producir
soluciones cupraminosas, usadas en para producir rayon. También se usa,
ocasionalmente, para suplemento dietario en animales, con deficiencia de cobre.
Oxido
Nitroso: propiedades narcóticas , en la industria alimenticia se utiliza para
hacer los alimentos (natas, yogures etc.) más espumosos, se utiliza también en
las combustiones de los motores convencionales o en algunos cohetes.
Óxido
férrico . En su estado natural es conocido como hematita. También es purificado
para su uso como soporte de almacenamiento magnético en audio e informática.
Esta es la forma de óxido comúnmente vista en hierros y estructuras de acero
oxidadas que ataca desde puentes hasta carrocerías de automóviles y la cual es
tremendamente destructiva.
Oxido
de etileno: sustancia química manufacturada usada principalmente para fabricar
glicol de etileno, y en cantidades muy pequeñas ( < 1% ) es usada para
controlar insectos en ciertos productos agrícolas almacenados, y una cantidad
muy pequeña se usa en hospitales para esterilizar equipo y abastecimientos
médicos.
- Hidróxido:
Depende del hidroxido, aqui hay algunos usos de
hidroxidos determinados :El hidróxido de calcio Ca (OH)2 es la cal apagada, muy
usada en mezclas con ladrillos para levantar paredes y para pintarlas.
- El hidróxido de magnesio Mg (OH)2 y el hidróxido de
aluminio Al(OH)3 son los antiácidos usados para aliviar la “acidez o ardor
estomacal”, es decir, la indigestión ácida y malestares estomacales. Se combinan
con el exceso ácido del estómago y se neutralizan.
- La soda cáustica es el hidróxido de sodio Na (OH); es
un sólido blanco, higroscópico y cáustico, muy empleado en la fabricación de
diversos productos, como: jabones, detergentes, papel, pasta de madera, fibras
artificiales, aceites, colorantes, derivados del petróleo, etc
- Ácido:
Se caracteriza por tener en su estructura hidrógeno acompañado de un elemento no metálico y en ocasiones oxigeno por lo que se puede calcificar en:
Ácidos
Hidrácidos De Un Alogenos
El ácido
fórmico, se utiliza, en los países en los que se encuentra autorizado, para
conservar zumos de frutas, especialmente los que se van a utilizar después
industrialmente. También para la conservación de ciertos encurtidos (pepinos)
en Alemania. En este caso se usa sobre todo el formiato cálcico, que actúa a la
vez como endurecedor.
El ácido
acético, en su forma de vinagre, que es esencialmente una disolución de este
ácido en agua, mas los aromas procedentes del vino y los formados en la
acidificación, se utiliza como conservante al menos desde hace 5.000 años. Una
gran parte del utilizado actualmente se obtiene por síntesis química. Como
conservante es relativamente poco eficaz, con excepción de una aplicación
específica en panadería y respostería, la evitación de la alteración conocida
como "pan filante". También es eficaz contra algunos mohos.
El ácido
carbónico ha contribuido a la protección de gaseosas desde su origen, aunque lo
ignoraran los fabricantes. Este producto es poco eficaz como conservante,
siendo esta propiedad un simple complemento de sus efectos estéticos y
organolépticos (confiere sabor ácido y una pungencia característica a las
bebidas). Al desplazar al oxígeno actúa también como antioxidante. Se utiliza
en el envasado de queso o de carne en atmósfera controlada para la venta al
detalle, y también para producir bebidas refrescantes gasificadas.
El ácido
propiónico, un ácido graso de cadena corta, y sus sales, se usan como
conservantes alimentarios desde los años cuarenta, especialmente en panadería.
Es el más efectivo contra los mohos de todos los conservantes, pero poco eficaz
contra levaduras y bacterias, con alguna excepción. Se utilizan especialmente
las sales, ya que el ácido tiene un olor muy fuerte. Son conservantes baratos.
Es un conservante fundamental en la fabricación del pan de molde, estando
autorizado para ello en la mayoría de los países. Esta aplicación por si sola
hace que, si se exceptúa la sal común, sea el conservante más utilizado en el
mundo. También se utiliza en algunos productos de repostería.
El ácido
cítrico y sus sales están diversificando su aplicación, sustituyendo materias
primas importadas, y es así como hoy en día ve su uso en renglones industriales
tan importantes como la industria de detergentes biodegradables. Las ventajas
principales de los citratos en las formulaciones de detergentes son su
biodegradabilidad y la facilidad de tratamiento, particularmente en
formulaciones que contienen zeolita.
El ácido
clorhídrico en la industria alimentaría se utiliza por ejemplo en la producción
de la gelatina disolviendo con ella la parte mineral de los huesos. En
metalurgia a veces se utiliza para disolver la capa de óxido que recubre un
metal, previo a procesos como galvanizado, extrusión, u otras técnicas.
El ácido
tartárico se usa a escala industrial en la preparación de bebidas
efervescentes, en algunas de sus formas el ácido tartárico se usa como
condimento para la comida, también se utiliza en fotografía y barnices y como
una variante de la sal de Rochelle como laxante suave.
El ácido
adipico se utiliza en la fabricación de fibras textiles e industriales.
El ácido
benzoico se emplea como conservante de alimentos es util contra levaduras,
bacterias y mohos.
El ácido
ascórbico o vitamina C, es un antioxidante, antigripal, sicatrizante.
El ácido
arsenioso es administrado en síndrome anémica en bovinos.
El ácido
acetilsalicilico, es la aspirina, cuya función es analgésica, antiporética,
antiagregante plaquetario y antiinflamatorio.
El ácido
fosfórico se utiliza en la fabricación de fertilizantes, en la refinación de
petróleo, producción de pigmentos, tratamiento del acero, extracción de metales
no ferrosos, manufactura de explosivos, detergentes, plásticos y fibras.
El ácido
sulfúrico se utiliza como medio de reacción en procesos químicos y orgánicos y
petroquímicos involucrando reacciones como nitraciones, condensaciones y
deshidrataciones.
El ácido
ditionoso o hiposulfito sódico tiene un gran poder reductor utilizándose en la
industria de colorantes para adherir el índigo y otros colorantes insolubles a
las fibras de los tejidos.
El ácido
oxálico empleado como quita mancha.
El ácido
hipocloroso es un fuerte desinfectante capaz de destruir la mayoría de los
organismos en menos de 2 segundos.
El ácido
fólico tiene acción antianémica.
El ácido
bórico, uso en esmaltes : para la fabricación de superficies duras, durables y
fácilmente lavables de cocinas, lavarropas, heladeras, bañeras, estufas,
hornos, chapas para nomenclaturas de calles, etc.
El ácido
málico se emplea en medicina y por su aroma agradable se usa en productos
alimenticios.
- Sales:
Son compuestos ternarios constituidos
por un no metal, oxígeno y metal. Se obtienen por neutralización total de un
hidróxido sobre un ácido oxoácido. La reacción que tiene lugar es:
ÁCIDO OXOÁCIDO + HIDRÓXIDO --> SAL
NEUTRA + AGUA
La neutralización completa del ácido
por la base lleva consigo la sustitución de todos los iones hidrógeno del ácido
por el catión del hidróxido, formándose además agua en la reacción. Puede,
pues, considerarse como compuestos binarios formados por un catión (proveniente
de la base) y un anión (que proviene del ácido).
En la fórmula se escribirá primero el
catión y luego el anión. Al leer la fórmula el orden seguido es el inverso.Para
nombrar las sales neutras, basta utilizar el nombre del anión correspondiente y
añadirle el nombre del catión, según hemos indicado anteriormente.
Si el anión tiene subíndice, se puede expresar
con los prefijos multiplicativos bis, tris, tetrakis, pentakis, etc. No
obstante, si se indica la valencia del metal no son precisos estos prefijos,
pues queda suficientemente clara la nomenclatura del compuesto
Para mas datos sobre el tema aquí les dejamos un vídeo que explica todo lo de arriba
BIBLIOGRAFIA:
http://espanol.answers.yahoo.com/question/index?qid=20070828191244AAtpTGT
http://www.profesorenlinea.cl/Quimica/Funcion_quimica.html
http://www.profesorenlinea.cl/Quimica/grupos_funcionales.html
http://espanol.answers.yahoo.com/question/index?qid=20070828191244AAtpTGT
http://espanol.answers.yahoo.com/question/index?qid=20120306102503AAPF9Nk
http://espanol.answers.yahoo.com/question/index?qid=20080205103529AATW8SO
Suscribirse a:
Entradas (Atom)